自主神经反射异常
什么是自主神经反射异常?
神经系统是一个复杂的网络,由许多“零部件”和“次零部件“组成。这些“零部件”之一是自主神经系统 (ANS),它控制着所有身体功能。 ANS 平衡它的“次零部件“,即交感神经和副交感神经系统。交感自主神经系统 (SANS) 加速身体反应,而副交感自主神经系统 (PANS) 减缓这些反应。这种组合使身体保持和谐运作。当受到威胁时,交感神经系统会在不受副交感神经系统控制的情况下加速,做出战斗或逃跑状态的反应。如果身体受到威胁,神经系统会释放能量作为反应。这是人类对威胁的通常反应。
交感神经和副交感神经系统部分功能的比较:
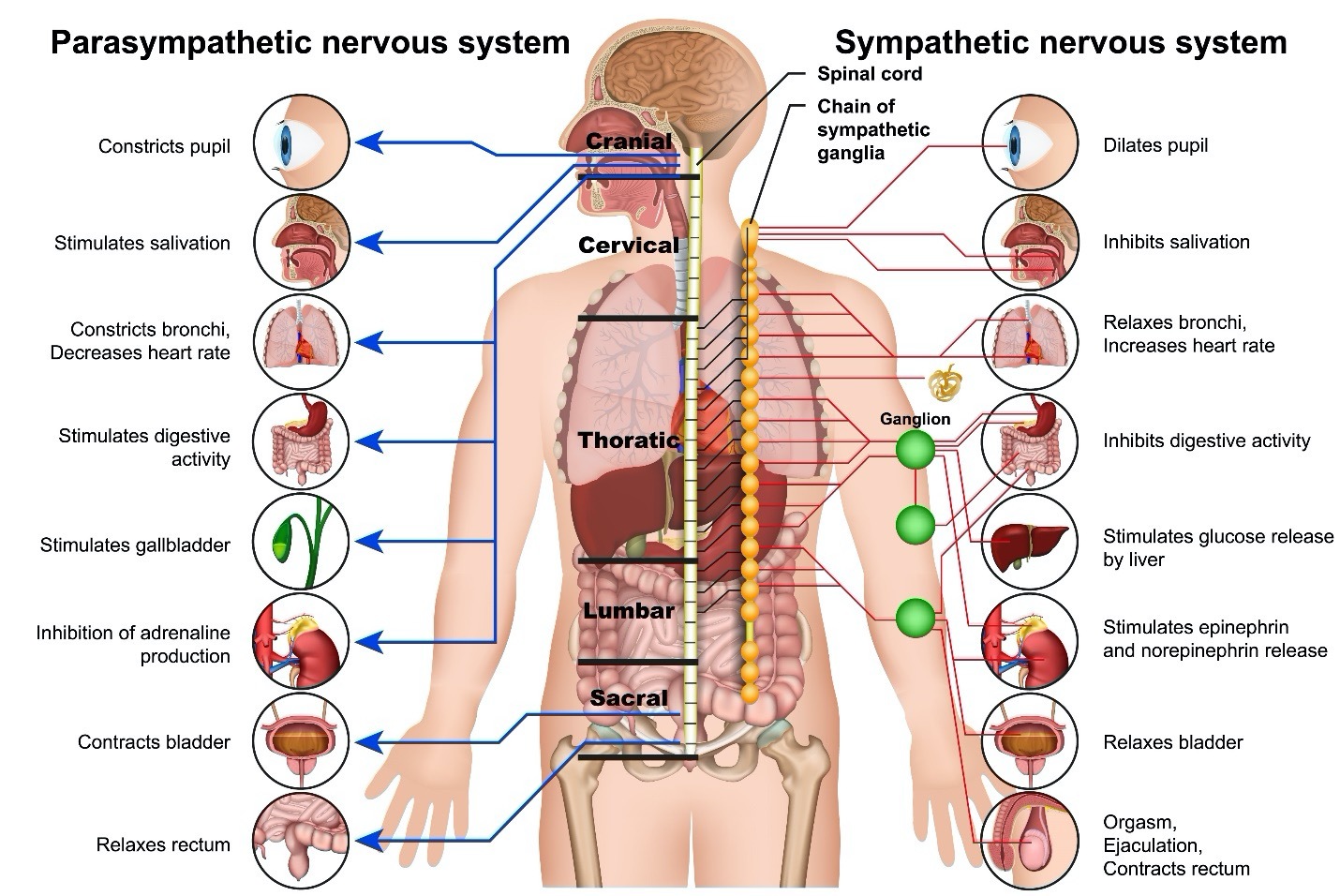
自主神经反射异常 (AD) 是自主神经系统出了问题。今天可能仍然听得到历来对 AD的称呼是自主神经功能障碍和反射亢进,因为有太多(过度)反射反应。自主神经系统 (ANS) 是神经系统的一部分,控制身体的活动,不需要个体有意识地思考它。这就是保持身体机能的机理,因此个体可以专注于其他事情。
体内发生的任何自动发生或不受个体控制的事情都由自主神经系统管理。这些身体活动包括数百种活动,例如心跳、呼吸、消化、血压调节、体温控制、对感染的反应、出汗、瘙痒、疼痛控制、保持肌肉放松、性唤起等等。身体的每一个功能都是由自主神经系统控制的。
在神经系统没有损伤的情况下,身体通过身体的感觉神经感觉到有害或不舒服的刺激。这些神经向大脑发送信号,告知问题是什么以及位置的细节。大脑解释信号并通过运动神经发出适当的反应来移动、转动、抓挠、调节体温、控制血压或以某种方式调节身体。
运动神经控制身体的所有运动。运动包括移动肌肉,让胳膊和腿发挥作用,还包括调节温度和血压以及身体内部的功能。上运动神经元(神经细胞)位于大脑中,它们的轴突或神经臂主要伸入较高的脊髓。中间神经元连接脊髓内的上下运动神经元。下运动神经元(神经)的位置在脊髓内,它们的轴突或神经臂离开椎管,延伸到身体本身。
影响上运动神经元的损伤会产生自主神经反射异常 (AD)。脊髓颈部或胸部区域(T6 以上)脊髓损伤的个体有患 AD 的风险,因为这是上运动神经元轴突或神经臂的位置。如果大脑或上脊髓中的上运动神经元受到影响,患有脑损伤、中风和其他神经系统疾病的个体也会处于风险之中。
神经系统损伤后,与大脑之间的信息传递可能只是部分的、缺失的或被误解的。但是,信息仍通过 ANS 的神经发送和接收。神经遍布全身,包括受伤部位。自动神经系统仍在工作,但可能与受伤前的水平不同。交感神经系统的能量爆发不是针对特定问题的微小反应,而是作为彻底的更正而释放出来的。副交感神经系统无法减缓释放。这是自主神经反射异常,一种无法控制的自动反射过度反应。由于 ANS 是自动控制的,个体无法有意识地改变或控制自己身体的自主神经反射异常反应。应立即开始紧急治疗。
自主神经反射障碍有风险的人
吉兰-巴雷综合症因疾病或上运动神经外伤而受损的个体有发生自主神经反射异常的风险。过去认为,T6 以上的脊髓损伤是 AD 的决定因素,但最近的研究表明,T10 及以上的脊髓损伤也有报告出现了类似的症状。
有其他影响上运动神经元损伤的个体也有患 AD 的风险。其中包括被诊断为脑损伤、中风、多发性硬化症、吉兰-巴雷综合症或其他神经系统疾病的个体。任何影响自主神经系统的疾病或损伤都可能导致自主神经反射异常的发作。脑损伤后一种特殊类型的自主神经紊乱是阵发性交感神经过度活跃 (PSH),其症状包括短暂发热、心动过速(心率加快)、高血压(高血压)、呼吸急促(呼吸急促)、出汗过多(出汗)、和特定的姿势。
被诊断出患有上述任何神经系统疾病,并不意味着就会患上 AD。目前还不知道为什么有些人会患上 AD 而另一些人则不会。也不完全了解为什么有些人的症状比其他人更严重。有一些罕见的个体在没有神经学诊断或不知道具体原因的情况下患有 AD。
自主神经反射异常 (AD) 的症状
AD 的症状特征因人而异。有些人的症状非常轻微,遗憾的是这些症状经常被忽视。其他人则有无行为能力的症状。请注意 AD 可能会出现任何、少数或所有症状。一些症状会随着不同的触发因素出现。大多数人都知道剧烈的头痛是 AD 的一种症状。剧烈的头痛是最常被提及的症状,但即使没有剧烈的头痛,也可以注意到列出的任何这些症状。忽视任何症状都可能危及生命,即使是轻微的。血压监测对于检测 AD 至关重要。血压高于正常范围会导致中风、心脏骤停、癫痫发作、视网膜出血、肺水肿,如果不及时治疗,甚至会导致死亡。
成人 AD 的典型症状是:
高于损伤水平之上
- 高血压(血压快速升高,收缩压比平时高 20-40 毫米汞柱)
- 心动过缓(心率慢)或心动过速(心率快)
- 剧烈的头痛
- 忧虑/焦虑/不安的感觉
- 视力变化
- 鼻塞
- 出汗
- 潮红的皮肤
- 鸡皮疙瘩
- 刺痛感
低于损伤水平以下
- 恶心
- 发冷但不发烧
- 湿冷的
- 发凉的
- 苍白
儿童 AD 的典型症状是:
高于损伤水平以上
- 高血压(血压快速升高,儿童收缩压比平时高 15 毫米汞柱,青少年收缩压比平时高 15-20 毫米汞柱)
- 心动过缓(心率慢)或心动过速(心率快)
- 大头痛
- 感到紧张/担心/害怕
- 脸颊/脖子/肩膀发红
- 视力模糊
- 鼻塞
- 出汗
- 鸡皮疙瘩
- 刺痛
低于损伤水平之下
- 胃部不适,感觉需要呕吐
- 发冷但不发烧
- 湿冷或冷汗
- 发凉
- 苍白
无症状自主神经反射异常
已经发现很多的证据表明有些患者在没有症状的情况下患有 AD。换句话说,血压升高而身体没有任何警报或症状。已经观察到在睡眠期间、膀胱评估过程和常规排便期间监测血压时,血压升高。在所有这些情况下,血压处于 AD 诊断/升高水平,但个体没有任何症状。重要的是,在日常活动中,监测患者的血压以评估 AD。如果患者的血压没有变化,可以偶尔进行监测。如果患者的血压有变化,请立即通知医生做进一步的评估和指导。
自主神经反射异常的诊断
通过评估血压来检测 AD 的存在。大多数情况下,如果注意到一个或多个症状时,应测量血压。患者需要了解他们平时的血压,因为随着时间的推移,神经系统疾病,尤其是脊髓损伤,由于心脏变化,血管反应减慢,血压往往会降低。患有 T6 或以上脊髓损伤的成年人可能无法保持他们受伤前的平均血压,但他们的正常血压通常为 90-110 毫米汞柱收缩压(最高数字)。患者需要了解他们的正常血压,以识别成人收缩压增加 20-40 毫米汞柱(最高数字),青少年收缩压增加 15-20 毫米汞柱,儿童收缩压增加 15 毫米汞柱。
上运动神经元损伤的患者会被怀疑自主神经反射异常。 AD 发作可以在患有神经系统疾病或损伤(例如中风、脑损伤、多发性硬化症、格林-巴利综合征等)的个体中随时发生。有些神经系统疾病是进行性的,因此无法确定发病时间,因为它发生在个体达到疾病的未知点时。
对于颈椎或胸椎脊髓损伤的患者,由于 T5 神经束的作用,AD 通常发生在 T6 以上的损伤中。扩大创伤和个体解剖结构的独特性。由于创伤时间过长和个体解剖结构的独特性,有些 T10 及以上受伤的人已经注意到 AD。 AD 被认为直到脊髓休克消退后才会发生,通常是从创伤开始后大约六周,但可以持续更长时间。然而,最近的研究表明 AD 可能在受伤的第一个月内发生。腰部或骶部脊髓损伤的患者下运动神经损伤不会产生 AD。
目前还没有血液测试或放射学方面的处理可以检测 AD,但是在 AD 发作期间或之后的一段时间内,血液中的儿茶酚胺和血管加压素水平会升高。
自主神经反射异常的诱因
AD的检测通常被认为是由于刺激身体进入AD发作的触发因素。触发因素是指身体在伤害水平以下感觉到有害或刺激的东西。如果某件小事或大事正在困扰身体,感觉减弱,则感觉神经无法有效或高效地向大脑发送信息以纠正这种情况。结果,ANS 通常会向运动神经发送信息以移动身体,从而纠正这种情况。然而,由于神经沟通不畅,发送了大量消息。这些信息无法被正确传递,导致体内神经活动的这种大规模爆发,通常高于受伤水平。
随着无症状AD 的发现,可能不会注意到触发因素或作为 AD 发作的刺激物。在无症状 AD 中,血压会在没有识别触发因素的情况下受到影响。 AD 发作可能在没有症状的情况下发生,这就是为什么它被称为无症状 AD。
触发因素包括对身体的各种有害来源或刺激。下面列出了常见的触发因素。不同患者有不同的触发因素。刺激 AD 发作的最常见有害刺激来自膀胱、肠道和皮肤。然而,可能的触发因素列表总是在增加。尽管患者的触发因素可能非常独特,触发因素可以分类。
- 膀胱被列为是引发 AD 发作的主要来源。最常见的原因是尿液没有排出体外,导致膀胱过度充盈。这可能包括导管扭结、导管堵塞、膀胱痉挛、逼尿肌-括约肌协同失调(DSD,膀胱和括约肌不能同时工作)、结石、感染或其他限制。对于某些患者来说,间歇性导管插入术或耻骨上导管可能是一种刺激物。通过膀胱镜检查(插入膀胱的范围)、尿动力学测试(评估膀胱功能)、冲击波碎石术(碎石)进行的膀胱检查也可能引发 AD。用于限制尿液的设备,例如过紧的腿袋带或过重或过满的腿袋、湿式防尿内衣或外部导管带也是罪魁祸首。
- AD 的第二个最常见的触发因素是肠道。快速运动引起的肠道过度膨胀、排便程序不完整或缺乏、嵌塞、便秘、胀气、定期或过度的手指刺激、灌肠或手动清除都是触发因素。腹泻或内部问题,如憩室炎、克罗恩病、裂隙和痔疮,也可能是有害刺激物。
- 皮肤问题是 AD 的第三大常见诱因。皮肤问题涵盖范围广泛,从无法感知或抓挠的瘙痒、皮疹、任何阶段的压力性损伤、割伤、瘀伤、骨折、向内生长的脚趾甲、脚趾甲过长、坐在起皱的床单上,甚至只是一股气流在你的手臂或腿的细毛上。过紧、松垮或松垮的紧身衣服、牛仔裤上的铆钉、不合身的鞋子、脚趾或腿部过紧的袜子、腰带、胸罩,服装等问题的清单不断增加。
随着越来越多的 AD 触发因素被确定,似乎任何麻烦都可能成为问题。这些是一些额外的触发因素:
- 内部温度变化,例如发烧或发冷,或外部温度变化,例如温暖或寒冷的环境
- 身体任何部位的痉挛
- 内部问题,例如胆囊发作/结石、阑尾炎、肝功能问题、胰腺炎、卵巢囊肿、前列腺炎、消化道溃疡、胃反流等。
- 性功能和互动、月经、怀孕、分娩、取精术
- 深静脉血栓形成 (DVT)(深静脉血栓形成)、肺栓塞 (PE)
- 异养骨化 (HO)(软组织中通常不存在骨骼)
- 体位性低血压 (OH)(坐着或站着时血压下降)
- 疼痛
- 使用电脑或明亮阳光对眼睛的影响
自主神经反射异常的治疗
AD 是一种医学上的紧急状况。当血压升高时,需要立即采取措施。如果需要,请随时拨打 911。
- 当AD 症状明显时,首先快速坐直。患者的躯干和臀部应该成 90 度角。如果患者自己无法做到这一点,请人帮助患者保持坐姿。当患者的血压突然下降时,由于血管无法足够快地收缩将血液冲向头部,从躺卧到坐立的突然转变利用了体位性低血压。
- 继续每 2-3 分钟监测一次血压,直至恢复正常。
- 进入坐姿时,松开身体上任何紧绷或束缚的东西。
- 寻找这 AD 发作的原因。首先检查 AD 的三个最常见的触发因素。检查尿流。必要时插管(如果没有尿量或尿量很少)。然后检查肠道是否有堵塞。如果存在大便,则清除肠道。然后检查皮肤去除皱纹、收缩或紧身衣服。患者可能从之前的 AD 发作中知道触发因素。如果患者知道这些,则校正患者常用的触发因素是一个好的开始。如果 AD 没有通过更正开始解决,请继续寻找并消除伤害级别以下的触发因素。
- 如果您有治疗 AD 的药物,请服用。药物可能包括起效快且持续时间短的抗高血压药。常用的处方药有:
- 硝基糊剂——1/2”(适用于 13 岁以下的患者)或 1”(适用于 13 岁及以上的患者),每 30 分钟涂抹一次,局部高于受伤水平。如果需要,重新涂抹。血压稳定后洗去硝基糊,以免血压过低。
- 硝苯地平(如果没有硝基糊剂)– 每剂 0.25-0.5 毫克/公斤(适用于 13 岁以下的患者)或每剂 10 毫克(适用于 13 岁及以上的患者),舌下(舌下)喷射速释剂) 或者如果是药丸形式,咀嚼它。可以根据需要每 20-30 分钟重复一次。
- 由于需要密切监测,只能在监测环境 (I.C.U.) 中使用 IV 抗高血压药。
- 用于治疗持续和危险的 AD 发作的其他药物包括硝苯地平、硝酸盐、卡托普利、特拉唑嗪、哌唑嗪、苯氧苄明、前列腺素 ED 和西地那非。应咨询您的医生,为您选择正确的药物
-
- 患者的血压应该开始降低并自行纠正。继续监测患者的血压至少两个小时。
-
- 如果找到并消除或纠正触发因素或多个触发因素,血压仍然升高,请拨打 911。需要立即就医以预防心血管事件,如中风、心脏骤停、癫痫发作、视网膜出血、肺水肿和死亡.
如果您已经确定了 AD 的特定触发因素,则可以使用其他药物和治疗方法来帮助控制这些已知原因。包括治疗逼尿肌括约肌协同失调 (DSD) 的药物、括约肌切开术(男性尿道括约肌的小肿块以解决膀胱压力增加)、改变正在使用的导管类型或在导管插入期间添加麻木药物。
如果肠道问题是 AD 的诱因,改变饮食来保持大便一致性、使用温和的栓剂和手指刺激方法或对肠道计划进行局部麻醉会有所帮助。
为了减少皮肤触发因素,可以使用药物来控制肌张力(痉挛),确保患者没有坐在有皱纹或其他皮肤刺激物上,进行压力释放并检查患者的皮肤是否有压力损伤,以及使用压力分散设备,并监控患者的腿袋,如果患者使用它则确保它在充满尿液时不会拉扯患者的腿,检查患者的鞋子以确保它们合脚并保持足部卫生,避免老茧和向内生长的脚趾甲破裂。移动时注意身体,以免受伤。保护患者的眼睛免受过度使用电脑和明亮阳光的伤害。
自主神经反射障碍视频
可以在此处查看来自 Reeve 基金会的解释自主神经反射障碍的原因和治疗方法的视频。
自主神经反射障碍钱包卡
为确保患者获得有关自主神经反射障碍 (AD) 的最新信息,请下载 Christopher &
Dana Reeve 基金会国家瘫痪资源中心的自主神经反射障碍钱包卡。此卡可以与医疗保健专业人员、护理人员、教师和其他人共享。钱包卡是一种易于携带的三折卡,可放入钱包中以便快速取用。它适用于成人和儿童以及多种语言。从以下网址下载 AD 钱包卡:
https://www.christopherreeve.org/zh/international/… 或致电 Reeve 信息专家 800-539-7309 领取免费打印副本。
自主神经反射障碍的康复治疗
患者需要参与 AD 发作的识别。当患者开始感觉到 AD 发作时,请坐起来开始治疗。寻求帮助以确保患者不会跌倒、伤害自己或失去知觉。如果无法确定触发因素或治疗方案无效,则应有人拨打 911。
可以对AD做诊断的理疗师、神经科医生、保健医生、医生或执业护士会提供适合患者的 AD 发作的治疗。如果发作很容易纠正,可能需要进行监测,并仔细考虑避免已识别的触发因素。在比较严重的情况下,开具治疗 AD 的药物。此外,如果患者的触发因素已知,则可以开具药物来减少触发因素,从而减少或消除 AD 发作。
康复注册护士是医院、康复医院或社区的护理提供者,可以向患者介绍 AD,帮助患者学习识别它以及如何治疗它。他们会帮助患者学习处理紧急情况。
泌尿科医生会提供治疗方法,例如膀胱麻木剂和治疗,以避免触发 AD。
家中的护理提供者可以协助监测患者的 AD 发作并提供紧急护理。他们通常必要时拨打 911 的人。
如果您患有 AD,您需要让您的所有医疗保健提供者和护理人员了解您的病情,以防万一,并且您没有时间寻求帮助。这包括使用策略提供治疗以避免 AD 发作的治疗师以及所有可以确保您安全的护理人员。
研究
通常对自主神经反射异常的原因和治疗方法的研究集中在个体触发因素上,例如肌张力亢奋(痉挛)、压力、膀胱和肠道问题。然而,医疗保健专业人员指出,那些因肌张力亢奋或神经性疼痛而接受治疗的人患 AD 的几率较低。这激发了人们的兴趣,对自主神经系统作为一个整体进行检查来治疗,而不仅仅是原因的“次零部件“ (Rabchevsky, et al., 2011)。
做了自主神经系统测试的研究,以确定是否可以分离 AD 的预测因子。深呼吸、Valsalva 动作和倾斜台测试挑战了脊髓损伤患者。对压力反射敏感性 (BRS) 的测量、心率和血压变异性的光谱分析以及儿茶酚胺和血管加压素水平的血液水平以及临床和放射学检查进行了评估。 AD 被 73.3% 的 SCI 患者证实,其中 63.6% 没有症状(Cívicos Sánchez 等,2021)。虽然目前这项研究在临床上并不实用,但它是对 AD 患者的有效评估,或许可以识别出没有症状的患者。
无症状 AD 最近被排到了对 ANS 中断患者的护理的最前沿。以前,人们认为 AD 只发生在有症状表现的个体中。最近,科学家在没有任何症状的个体中发现了 AD。表现为血压升高,但身体舒适度没有变化。对于有严重并发症风险但没有任何警告的个人来说,无症状 AD是一个非常关键的问题(Kirshblum 等人,2002 年;Linsenmeyer 等人,1996 年)。
对小鼠的研究表明,AD 会影响免疫系统功能进一步下降。对一位患者的后续研究发现,儿茶酚胺释放过多会影响免疫系统,这表明 AD 可能是 SCI 后免疫缺陷的次要原因(Zhang, et al., 2013)。因为 SCI 对免疫功能下降有影响,这一新信息需要进一步研究。加上神经系统的神经炎症,正在研究 AD 对免疫系统的进一步影响,治疗方法尚未确定(Mironets 等人,2018 年)
事实与数据
T6 级或以上脊髓损伤的患者 AD 发生率为 48-90%。
无症状 AD 在 T6 或以上水平的 SCI 患者中普遍存在,发病率为 42.9-63.6%。
在单个地方进行研究中,T6 或以上脊髓损伤的 13 岁及以下儿童的 AD 发生率为 51%。
AD 死亡率为 22%,使中风风险增加 300% 至 400%。
自主神经反射异常更多发生在脊髓完全分类的患者中,发病率为 91%,而不是分类不完全的患者,发病率为 27%。脊髓完全分类的AD发病时间较短,而分类不完全的AD发病时间较长。
在一项对 349 例报告病例的研究中,脑外伤中自主神经功能障碍的发生率:
- 外伤性脑损伤 (TBI) 79.4%
- 缺氧 9.7%
- 脑血管意外或中风 5.4%
消费者资源
如果您正在寻找有关自主神经反射异常的更多信息或有特定问题,请在工作日周一至周五(东部时间上午 7 点至晚上 12 点)拨打免费电话 800-539-7309,咨询我们的信息专家。
参考文献:
Baguley IJ, Perkes IE, Fernandez-Ortega JF, Rabinstein AA, Dolce G, Hendricks HT; Consensus Working Group. Paroxysmal sympathetic hyperactivity after acquired brain injury: consensus on conceptual definition, nomenclature, and diagnostic criteria. J Neurotrauma. 2014 Sep 1;31(17):1515-20. doi: 10.1089/neu.2013.3301. Epub 2014 Jul 28. PMID: 24731076.
Canon S, Shera A, Phan NM, Lapicz L, Scheidweiler T, Batchelor L, Swearingen C. Autonomic dysreflexia during urodynamics in children and adolescents with spinal cord injury or severe neurologic disease. J Pediatr Urol. 2015 Feb;11(1):32.e1-4. doi: 10.1016/j.jpurol.2014.08.011. Epub 2014 Oct 8. PMID: 25697979.
Caruso D, Gater D, Harnish C. Prevention of recurrent autonomic dysreflexia: a survey of current practice. Clin Auton Res. 2015 Oct;25(5):293-300. doi: 10.1007/s10286-015-0303-0. Epub 2015 Aug 18. PMID: 26280219.
Cívicos Sánchez N, Acera M, Murueta-Goyena A, Sagastibeltza N, Martínez R, Cuadrado M, Orueta A, Tijero B, Fernández T, Del Pino R, Gabilondo I, Jauregui Abrisqueta ML, Gómez Esteban JC. Quantitative analysis of dysautonomia in patients with autonomic dysreflexia. J Neurol. 2021 Aug;268(8):2985-2994. doi: 10.1007/s00415-021-10478-w. Epub 2021 Feb 25. PMID: 33634338.
Cowan H, Lakra C, Desai M, Autonomic dysreflexia in spinal cord injury. BMJ 2020;371:m3596. doi: https://doi.org/10.1136/bmj.m3596.
Ekland MB, Krassioukov AV, McBride KE, Elliott SL. Incidence of autonomic dysreflexia and silent autonomic dysreflexia in men with spinal cord injury undergoing sperm retrieval: implications for clinical practice. J Spinal Cord Med. 2008;31(1):33-9. doi: 10.1080/10790268.2008.11753978. PMID: 18533409; PMCID: PMC2435024.
Eldahan KC, Rabchevsky AG. Autonomic dysreflexia after spinal cord injury: Systemic pathophysiology and methods of management. Auton Neurosci. 2018 Jan;209:59-70. doi: 10.1016/j.autneu.2017.05.002. Epub 2017 May 8. PMID: 28506502; PMCID: PMC5677594.
Giannantoni A, Di Stasi SM, Scivoletto G, Mollo A, Silecchia A, Fuoco U, Vespasiani G. Autonomic dysreflexia during urodynamics. Spinal Cord. 1998 Nov;36(11):756-60. doi: 10.1038/sj.sc.3100684. PMID: 9848482.
Helkowski WM, Ditunno JF Jr, Boninger M. Autonomic dysreflexia: incidence in persons with neurologically complete and incomplete tetraplegia. J Spinal Cord Med. 2003 Fall;26(3):244-7. doi: 10.1080/10790268.2003.11753691. PMID: 14997966.
Hickey KJ, Vogel LC, Willis KM, Anderson CJ. Prevalence and etiology of autonomic dysreflexia in children with spinal cord injuries. J Spinal Cord Med. 2004;27 Suppl 1:S54-60. doi: 10.1080/10790268.2004.11753786. PMID: 15503704.
Huang YH, Bih LI, Liao JM, Chen SL, Chou LW, Lin PH. Blood pressure and age associated with silent autonomic dysreflexia during urodynamic examinations in patients with spinal cord injury. Spinal Cord. 2013 May;51(5):401-5. doi: 10.1038/sc.2012.155. Epub 2012 Dec 11. PMID: 23229618.
Karlsson AK. Autonomic dysreflexia. Spinal Cord. 1999 Jun;37(6):383-91. doi: 10.1038/sj.sc.3100867. PMID: 10432257.
Kirshblum SC, House JG, O’connor KC. Silent autonomic dysreflexia during a routine bowel program in persons with traumatic spinal cord injury: a preliminary study. Arch Phys Med Rehabil. 2002 Dec;83(12):1774-6. doi: 10.1053/apmr.2002.36070. PMID: 12474185.
Krassioukov AV, Furlan JC, Fehlings MG. Autonomic dysreflexia in acute spinal cord injury: an under-recognized clinical entity. J Neurotrauma. 2003 Aug;20(8):707-16. doi: 10.1089/089771503767869944. PMID: 12965050.
Krassioukov A, Warburton DE, Teasell R, Eng JJ; Spinal Cord Injury Rehabilitation Evidence Research Team. A systematic review of the management of autonomic dysreflexia after spinal cord injury. Arch Phys Med Rehabil. 2009 Apr;90(4):682-95. doi: 10.1016/j.apmr.2008.10.017. PMID: 19345787; PMCID: PMC3108991.
Lee ES, Joo MC. Prevalence of autonomic dysreflexia in patients with spinal cord injury above T6. Biomed Res Int. 2017;2017:2027594. doi: 10.1155/2017/2027594. Epub 2017 Oct 26. PMID: 29226126; PMCID: PMC5684522.
Linsenmeyer TA, Campagnolo DI, Chou IH. Silent autonomic dysreflexia during voiding in men with spinal cord injuries. J Urol. 1996 Feb;155(2):519-22. PMID: 8558650.
Liu N, Zhou M, Biering-Sørensen F, Krassioukov AV. Iatrogenic urological triggers of autonomic dysreflexia: a systematic review. Spinal Cord. 2015 Jul;53(7):500-9. doi: 10.1038/sc.2015.39. Epub 2015 Mar 24. PMID: 25800696.
Meyfroidt G, Baguley IJ, Menon DK. Paroxysmal sympathetic hyperactivity: the storm after acute brain injury. Lancet Neurol. 2017 Sep;16(9):721-729. doi: 10.1016/S1474-4422(17)30259-4. Erratum in: Lancet Neurol. 2018 Mar;17 (3):203. PMID: 28816118.
Mironets E, Osei-Owusu P, Bracchi-Ricard V, Fischer R, Owens EA, Ricard J, Wu D, Saltos T, Collyer E, Hou S, Bethea JR, Tom VJ. Soluble TNFα Signaling within the spinal cord contributes to the development of autonomic dysreflexia and ensuing vascular and immune dysfunction after spinal cord injury. J Neurosci. 2018 Apr 25;38(17):4146-4162. doi: 10.1523/JNEUROSCI.2376-17.2018. Epub 2018 Apr 2. PMID: 29610439; PMCID: PMC5963850.
Naftchi NE, Richardson JS. Autonomic dysreflexia: pharmacological management of hypertensive crises in spinal cord injured patients. J Spinal Cord Med. 1997 Jul;20(3):355-60. PMID: 9261783.
Perkes I, Baguley IJ, Nott MT, Menon DK. A review of paroxysmal sympathetic hyperactivity after acquired brain injury. Ann Neurol. 2010 Aug;68(2):126-35. doi: 10.1002/ana.22066. PMID: 20695005.
Perrouin-Verbe B, Courtois F, Charvier K, Giuliano F. Sexualité de la patiente neurologique [Sexuality of women with neurologic disorders]. Prog Urol. 2013 Jul;23(9):594-600. French. doi: 10.1016/j.purol.2013.01.004. Epub 2013 Mar 7. PMID: 23830253.
Rabchevsky AG, Kitzman PH. Latest approaches for the treatment of spasticity and autonomic dysreflexia in chronic spinal cord injury. Neurotherapeutics. 2011 Apr;8(2):274-82. doi: 10.1007/s13311-011-0025-5. PMID: 21384222; PMCID: PMC3101828.
Teasell RW, Arnold JM, Krassioukov A, Delaney GA. Cardiovascular consequences of loss of supraspinal control of the sympathetic nervous system after spinal cord injury. Arch Phys Med Rehabil. 2000 Apr;81(4):506-16. doi: 10.1053/mr.2000.3848. PMID: 10768544.
Weaver LC, Marsh DR, Gris D, Brown A, Dekaban GA. Autonomic dysreflexia after spinal cord injury: central mechanisms and strategies for prevention. Prog Brain Res. 2006;152:245-63. doi: 10.1016/S0079-6123(05)52016-8. PMID: 16198705.
Zhang Y, Guan Z, Reader B, Shawler T, Mandrekar-Colucci S, Huang K, Weil Z, Bratasz A, Wells J, Powell ND, Sheridan JF, Whitacre CC, Rabchevsky AG, Nash MS, Popovich PG. Autonomic dysreflexia causes chronic immune suppression after spinal cord injury. J Neurosci. 2013 Aug 7;33(32):12970-81. doi: 10.1523/JNEUROSCI.1974-13.2013. PMID: 23926252; PMCID: PMC3735880.

